心理动力学疗法与情感聚焦疗法
什么是心理动力学疗法?
心理动力学疗法是一种心理治疗方法,它基于弗洛伊德的精神分析理论,但更加注重当前的人际关系和情绪体验。动力学疗法的治疗师通过探索来访者的潜意识冲突和早期经历来帮助他们理解并解决当前的问题。
情感聚焦疗法(EMOTION-FOCUSED THERAPY)
情感聚焦疗法是一种以情感为中心的心理治疗方法,旨在帮助来访者识别、表达和处理原发情绪和继发情绪。这种方法强调共情的理解和支持,帮助来访者在安全的环境中探索和表达自己的情感。
初级培训生的刻意练习
对于初级培训生来说,刻意练习是提高专业技能的关键。这包括在督导的指导下进行个案概念化的练习,以及学习如何有效地与来访者建立治疗关系。通过不断的实践和反馈,培训生可以逐渐提高自己的临床技能。
个案概念化的重要性
个案概念化是心理治疗中的一个重要环节,它涉及对来访者问题的全面评估和理解。通过个案概念化,治疗师可以制定出更有效的治疗计划,帮助来访者更好地应对他们的挑战。
共情的作用
共情是心理治疗中不可或缺的一部分。通过共情,治疗师能够更好地理解来访者的情感和需求,从而提供更有针对性的支持和干预。共情不仅有助于建立信任的治疗关系,还能促进来访者的情感表达和自我探索。
什么是胶质细胞及其功能?
什么是胶质细胞?
胶质细胞,也称为神经胶质细胞,是非神经元细胞,位于中枢神经系统和周围神经系统中,为神经元提供物理和代谢支持,包括神经元的绝缘和通信,以及营养和废物运输。
胶质细胞是一个统称,包括多种类型的细胞,例如小胶质细胞、星形胶质细胞和施万细胞,每种细胞在体内都有其特定的功能。每种类型的胶质细胞执行特定的任务,以保持大脑的正常运作。
据信,德国生物学家鲁道夫·菲尔肖于1856年首次发现了胶质细胞。在寻找大脑中的结缔组织时,菲尔肖识别出了与神经元相连的物质。
这种物质在德语中被称为nervenkitt,在希腊语中被称为neuroglial,两者都翻译为神经胶质。人们认为胶质细胞仅作为神经元的粘合剂,具有被动作用,而神经元在大脑中则具有主动作用。
后来的一些研究者提出,胶质细胞为神经元提供营养,而另一些人则认为它们可能是神经元电活动的绝缘体。
现在,我们对胶质细胞在大脑中的作用有了更深入的了解,认识到它们在维持大脑和周围区域的整体功能方面发挥着积极且重要的作用。
胶质细胞在结构上与神经元不同。神经元具有轴突和树突,用于在其他神经细胞之间传递电信号。然而,胶质细胞没有轴突或树突。
这意味着胶质细胞不会直接参与突触相互作用和电信号传递,尽管它们在帮助神经元维持这些功能方面起着支持作用。
此外,尽管胶质细胞从细胞体延伸出复杂的分支,但由于它们没有轴突或树突,通常比神经元要小。星形胶质细胞是最大的胶质细胞类型,直径为40-50微米。
中枢神经系统(CNS)中的胶质细胞
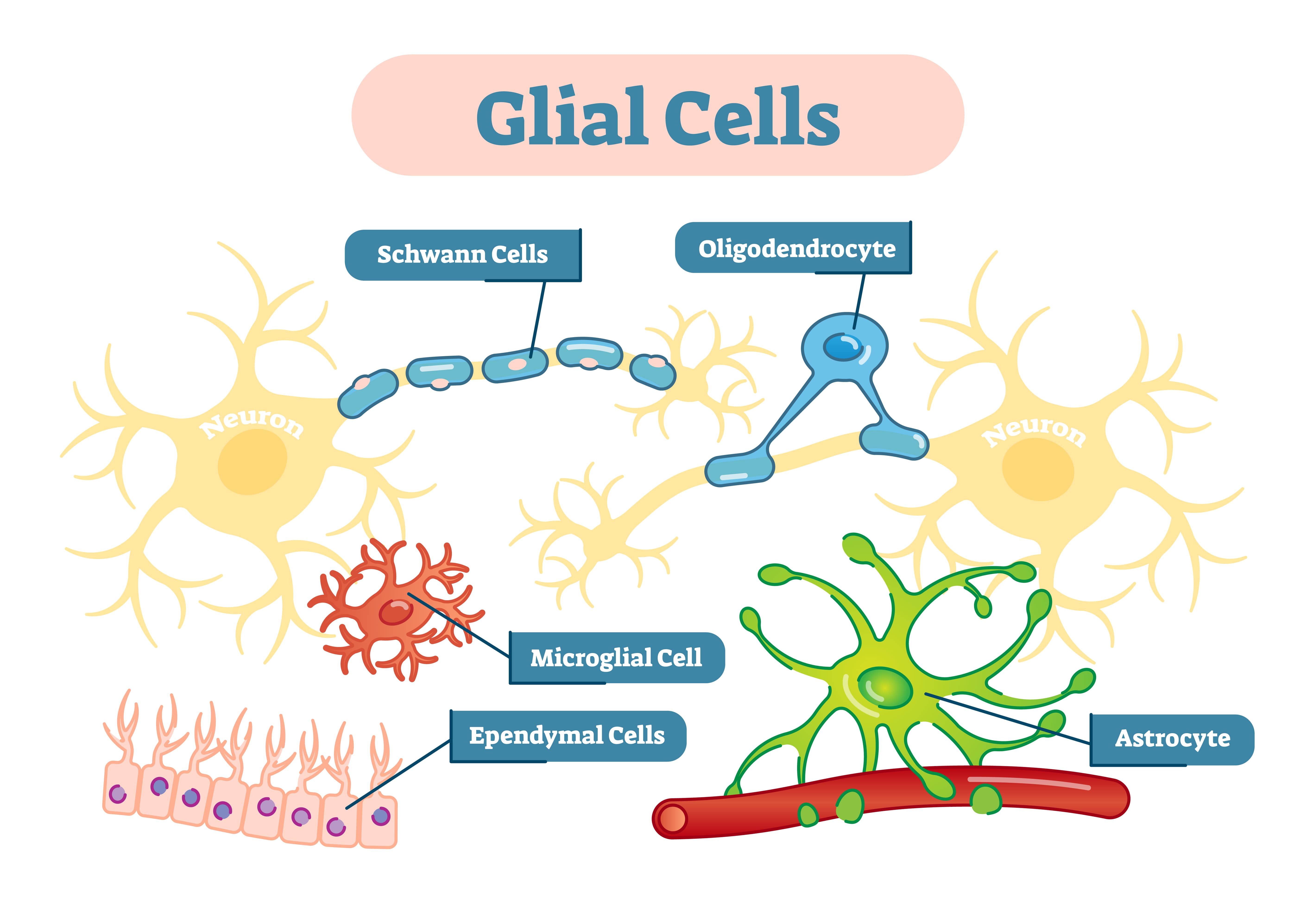
星形胶质细胞
星形胶质细胞是仅存在于大脑和脊髓中的星形细胞。它们的主要作用是维持神经细胞周围的环境,以支持它们之间的信号传递。
它们通过调节神经递质水平来实现这一点,特别是在突触(神经细胞之间的连接)周围。星形胶质细胞可以感知神经递质水平,并释放直接影响神经细胞活动的分子。这使它们在修改突触和神经细胞之间的通信方面变得重要。
例如,谷氨酸是一种兴奋性神经递质,可刺激大脑活动。星形胶质细胞回收多余的谷氨酸,以防止神经元过度刺激。
星形胶质细胞还回收神经信号传递后剩余的神经递质。
此外,当神经细胞死亡时,它们还会清理碎片并去除多余的钾离子。钾是一种对神经功能至关重要的化学物质。
此外,星形胶质细胞还有助于形成血脑屏障。这个屏障过滤掉有害物质,以保持大脑健康。星形胶质细胞还储存血糖,为神经细胞提供燃料,并帮助调节大脑的新陈代谢。
当星形胶质细胞功能失调时,它们将无法正确滋养神经元。
星形胶质细胞功能失调已与ALS、亨廷顿病和帕金森病等神经退行性疾病相关联(Phatnani & Maniatis, 2015)。
在这些疾病中,星形胶质细胞会变得“反应性”,改变其形状和行为。这可能有好有坏。它可能有助于隔离受损区域,但也可能释放有害的炎症化学物质,损害神经元(Liddelow et al., 2017)。
少突胶质细胞
少突胶质细胞在大脑和脊髓中围绕神经细胞轴突形成髓鞘。髓鞘由脂肪组成,为轴突提供绝缘,轴突是神经细胞的长线状部分。
这种绝缘使电信号能够更快地沿轴突传播。
如果没有髓鞘,信号会慢得多,导致大脑功能受损。多发性硬化症等疾病会损害髓鞘。少突胶质细胞还从血液中向轴突提供营养。
与少突胶质细胞问题相关的其他疾病包括影响髓鞘的白质营养不良和脑肿瘤少突胶质细胞瘤。
异常髓鞘形成还与精神健康状况如精神分裂症有关(Scheel et al., 2013),在患有这种疾病的前额叶皮层和海马区发现少突胶质细胞密度降低(Schmitt et al., 2019)。
少突胶质细胞功能失调还与双相情感障碍有关(Konradi et al., 2012)。
小胶质细胞
小胶质细胞充当大脑和脊髓的免疫细胞。它们监测损伤和疾病,并通过清除死亡细胞和去除毒素或入侵生物来作出反应。
这种炎症反应有助于愈合损伤,但有时也会引起问题。例如,在阿尔茨海默病中,小胶质细胞可能会过度活跃,导致过多的炎症。
小胶质细胞还在大脑发育和可塑性中发挥作用。它们修剪不必要的神经细胞连接,只留下最重要的连接。
功能失调与慢性疼痛和纤维肌痛等疾病有关(Ohgidani et al., 2017)。
在自闭症谱系障碍(ASD)患者的大脑中,小胶质细胞的密度和激活程度高于神经典型大脑,表明神经炎症可能在ASD中起作用(Tetreault et al., 2012)。
室管膜细胞
室管膜细胞衬在大脑中的室和脊髓的中央管内。这些细胞形成一层薄薄的膜,称为室管膜。
在脑室中,室管膜细胞具有称为纤毛的微小毛发状突起,来回移动以循环脑脊液。
脑脊液(CSF)为大脑和脊髓输送营养物质,同时清除废物。它还起到缓冲作用,保护大脑,并通过调节温度来维持稳态。室管膜细胞产生这种重要的液体。
如果室管膜细胞受损,会影响脑脊液的生产和流动。这会导致废物积聚,使营养物质更难到达大脑和脊髓。它还会消除缓冲效果,增加受伤的风险。
室管膜细胞功能障碍与脑积水有关,这是一种大脑内液体过度积聚的状况(Ji et al., 2022),还与多发性硬化症有关(Hatrock et al., 2020)。
室管膜细胞功能受损可能导致脑脊液成分改变和废物清除障碍。在阿尔茨海默病等疾病中,脑脊液流动受阻表明室管膜细胞未能有效清除废物。这可能进一步促进神经退行性变(Nelles & Hazrati, 2022)。
径向胶质细胞
径向胶质细胞被认为是大脑中的一种干细胞,这意味着它们可以生成新的细胞。它们作为前体细胞,创造出神经元、星形胶质细胞和少突胶质细胞。
当你还是胚胎时,径向胶质细胞提供了支架,引导新脑细胞在发育过程中就位。
径向胶质细胞还对大脑的可塑性和适应能力做出了贡献。它们作为干细胞的作用使它们成为研究者关注的焦点,研究者希望利用它们修复因损伤或疾病引起的大脑损害。
由于径向胶质细胞创造了其他重要的脑细胞,因此对它们的损害会损害神经元的产生和功能。这可能潜在地导致神经退行性疾病。
它们的功能障碍也可能减少大脑形成新连接的能力,影响学习。
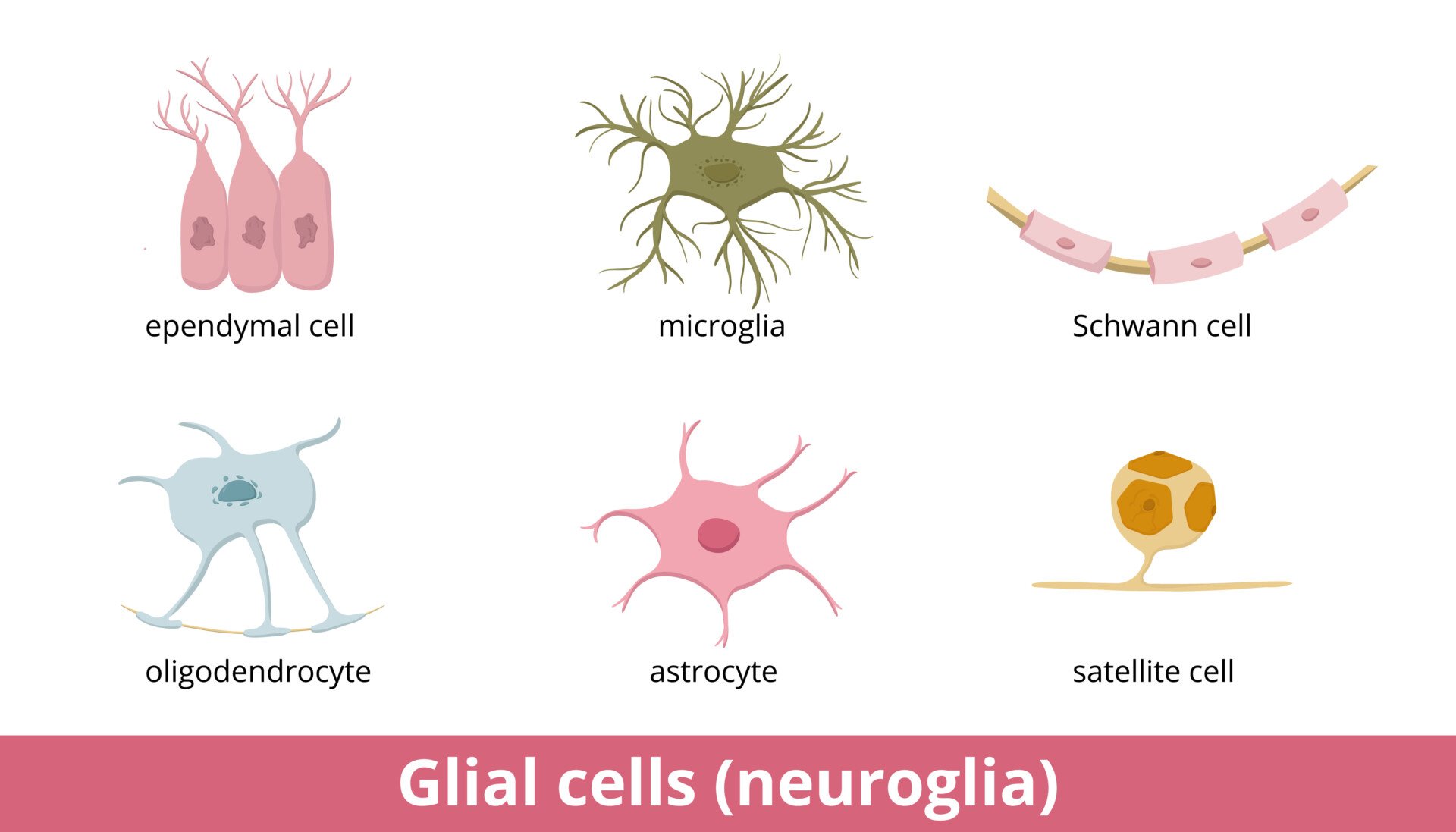
外周神经系统中的胶质细胞
施万细胞
施万细胞为外周神经系统中神经细胞的轴突提供髓鞘绝缘,类似于中枢神经系统中的少突胶质细胞。
施万细胞的膜螺旋缠绕在轴突上,形成髓鞘。这使得沿神经的电信号传输速度更快。
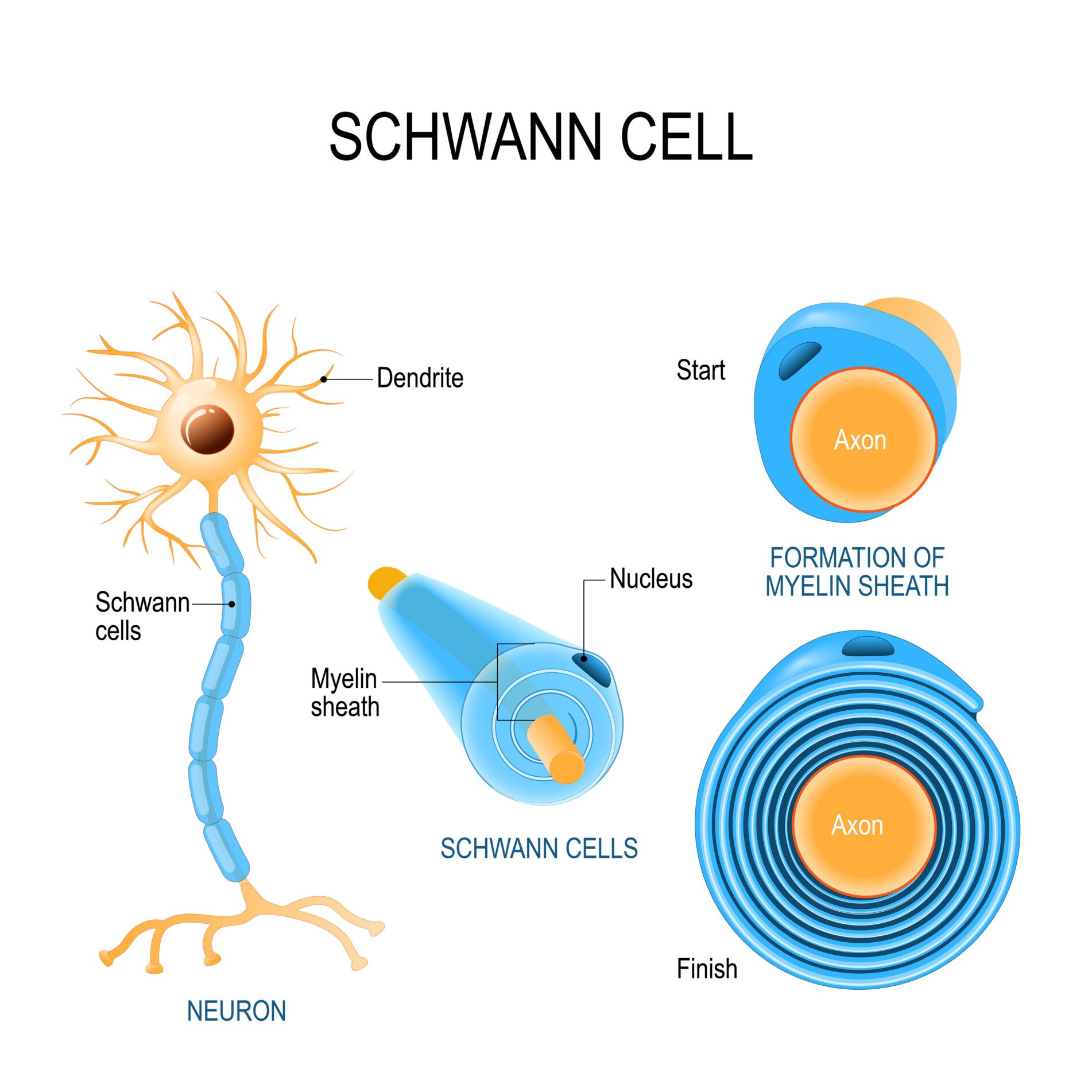
与少突胶质细胞不同,每个施万细胞只髓鞘化一个轴突。施万细胞还参与受损外周神经的再生。当受伤发生时,它们帮助清除碎片并为新轴突纤维的再生提供路径。
施万细胞的异常髓鞘化可能导致外周神经系统的功能丧失。这可能会导致麻木、无力、瘫痪或疼痛信号。
涉及施万细胞的疾病包括吉兰-巴雷综合征,它会导致外周神经损伤,以及夏科-马里-图斯病,这是一种遗传性周围神经病变。
研究表明,施万细胞的功能障碍会导致其内部成分的压力,这可能是它们在某些神经病变中触发有害炎症的原因。这为新的治疗方法提供了可能的目标(Ydens et al., 2013)。
卫星细胞
卫星细胞位于感觉、交感和副交感神经节中,这些神经节是神经细胞体的簇。
它们围绕着这些神经节中的神经细胞体。卫星细胞被认为与中枢神经系统中的星形胶质细胞类似。
它们的主要作用似乎是调节神经细胞周围的环境,包括营养支持和保护。
它们可能吸收毒素以防止神经元受损。卫星细胞还像小胶质细胞一样响应损伤和炎症。
卫星细胞的功能障碍可能扰乱它们所在的神经节。例如,在感觉神经节中,这可能会影响视觉、听觉或触觉等感官。
它们的功能障碍也可能损害由自主神经系统控制的脑部与内脏器官之间的通信。
涉及卫星细胞功能的基因突变可能直接导致称为“原发性卫星细胞病”的肌肉疾病,其中肌肉无力和萎缩主要由肌肉干细胞的功能障碍引起(Servian-Morilla et al., 2021)。
即使在不是由卫星细胞突变直接引起的肌肉疾病中,随着肌肉损伤的增加,仍可能间接损害卫星细胞的再生能力,如在运动神经元疾病如ALS和脊髓性肌萎缩症中可能发生的情况(Ganassi et al., 2022)。
常见问题
胶质细胞的作用是什么?
胶质细胞是非神经元细胞,为中枢神经系统中的神经元提供支持和保护。
它们调节神经递质,隔离神经元,摧毁病原体,指导神经元在发育过程中的迁移,促进突触可塑性,并清除死亡的神经元。
胶质细胞对于神经系统的正常功能至关重要。
胶质细胞会产生髓鞘吗?
是的,某些类型的胶质细胞,如少突胶质细胞和施万细胞,分别在中枢神经系统和外周神经系统中产生神经轴突上的髓鞘。
髓鞘作为一种绝缘层,通过防止电信号从轴突泄漏来增加神经信号的传输速度。
胶质细胞产生的髓鞘对于神经元的正常功能和通信至关重要。
为什么胶质细胞对神经元和大脑功能很重要?
胶质细胞至关重要,因为它们帮助维持神经元正常功能所需的微环境。
它们为神经元提供营养和能量,调节神经递质水平,绝缘轴突,并保护神经元免受损伤和感染。
胶质细胞功能障碍会影响心理健康吗?
是的,新兴研究表明,胶质细胞异常与抑郁症、焦虑症、精神分裂症和双相情感障碍等疾病有关。
功能障碍的星形胶质细胞和小胶质细胞可能有助于引发损害神经元的炎症。
靶向胶质细胞能否为神经退行性疾病带来新的治疗方法?
有可能。关于操纵反应性星形胶质细胞和小胶质细胞以减少阿尔茨海默病等疾病中的炎症的研究前景看好。
增强少突胶质细胞也可能有助于修复髓鞘损伤。需要更多的研究。
参考文献
Ganassi, M., & Zammit, P. S. (2022). Involvement of muscle satellite cell dysfunction in neuromuscular disorders: Expanding the portfolio of satellite cell-opathies. European Journal of Translational Myology, 32(1).
Hatrock, D., Caporicci-Dinucci, N., & Stratton, J. A. (2020). Ependymal cells and multiple sclerosis: proposing a relationship. Neural regeneration research, 15(2), 263.
Jäkel, S., & Dimou, L. (2017). Glial cells and their function in the adult brain: a journey through the history of their ablation. Frontiers in cellular neuroscience, 11, 24.
Ji, W., Tang, Z., Chen, Y., Wang, C., Tan, C., Liao, J., … & Xiao, G. (2022). Ependymal cilia: Physiology and role in hydrocephalus. Frontiers in Molecular Neuroscience, 15, 927479.
Konradi, C., Sillivan, S. E., & Clay, H. B. (2012). Mitochondria, oligodendrocytes and inflammation in bipolar disorder: evidence from transcriptome studies points to intriguing parallels with multiple sclerosis. Neurobiology of disease, 45(1), 37-47.
Liddelow, S. A., Guttenplan, K. A., Clarke, L. E., Bennett, F. C., Bohlen, C. J., Schirmer, L., … & Barres, B. A. (2017). Neurotoxic reactive astrocytes are induced by activated microglia. Nature, 541(7638), 481-487.
Nelles, D. G., & Hazrati, L. N. (2023). The pathological potential of ependymal cells in mild traumatic brain injury. Frontiers in Cellular Neuroscience, 17, 1216420.
Ohgidani, M., Kato, T. A., Hosoi, M., Tsuda, M., Hayakawa, K., Hayaki, C., … & Kanba, S. (2017). Fibromyalgia and microglial TNF-α: translational research using human blood induced microglia-like cells. Scientific reports, 7(1), 11882.
Phatnani, H., & Maniatis, T. (2015). Astrocytes in neurodegenerative disease. Cold Spring Harbor perspectives in biology, 7(6), a020628.
Purves, D. A. GJ., Fitzpatrick, D., et al. (2001). Neuroscience 2nd edition. Neuroglial cells.
Scheel, M., Prokscha, T., Bayerl, M., Gallinat, J., & Montag, C. (2013). Myelination deficits in schizophrenia: evidence from diffusion tensor imaging. Brain Structure and Function, 218, 151-156.
Servián-Morilla, E., Cabrera-Serrano, M., Johnson, K., Pandey, A., Ito, A., Rivas, E., … & Paradas, C. (2020). POGLUT1 biallelic mutations cause myopathy with reduced satellite cells, α-dystroglycan hypoglycosylation and a distinctive radiological pattern. Acta neuropathologica, 139, 565-582.
Schmitt, A., Simons, M., Cantuti-Castelvetri, L., & Falkai, P. (2019). A new role for oligodendrocytes and myelination in schizophrenia and affective disorders?. European Archives of Psychiatry and Clinical Neuroscience, 269, 371-372.
Tetreault, N. A., Hakeem, A. Y., Jiang, S., Williams, B. A., Allman, E., Wold, B. J., & Allman, J. M. (2012). Microglia in the cerebral cortex in autism. Journal of Autism and Developmental Disorders, 42(12), 2569-2584.
Ydens, E., Lornet, G., Smits, V., Goethals, S., Timmerman, V., & Janssens, S. (2013). The neuroinflammatory role of Schwann cells in disease. Neurobiology of disease, 55, 95-103.
引用来源
本文翻译自以下网站:
simplypsychology.org
使用声明
本文仅供教育和参考用途。如需转载或引用,请注明出处和作者。
如果你有任何问题或建议,请随时联系微信公众号。