髓鞘
髓鞘
髓鞘是一种在中枢神经系统(CNS)和周围神经系统(PNS)中发现的物质。
髓鞘是包裹在神经元轴突上的保护层,有助于绝缘神经元并增加电信号的传递数量。
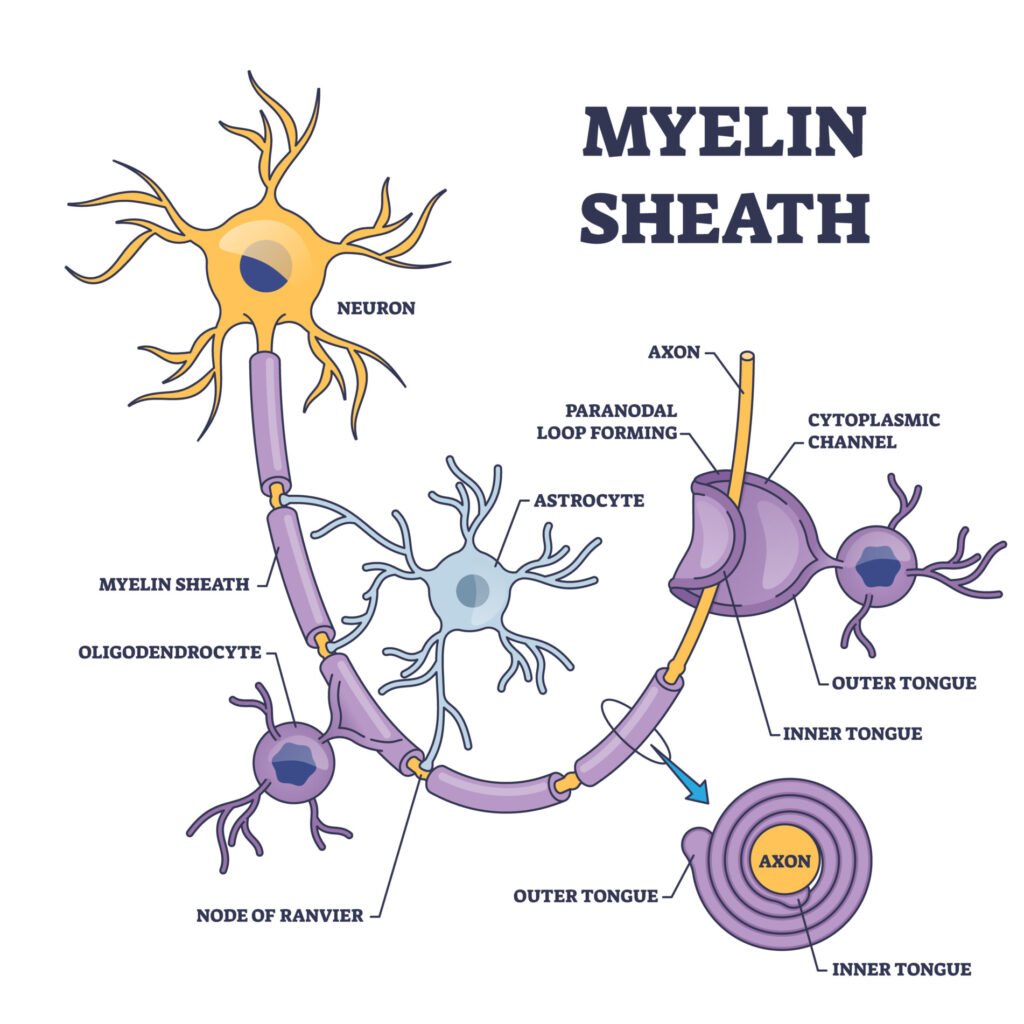
髓鞘是一种富含脂质的绝缘层,包裹着许多神经细胞的轴突。它由中枢神经系统中的少突胶质细胞和周围神经系统中的施万细胞产生,旨在提高神经冲动的速度。髓鞘是分段的,有称为郎飞氏结的间隙,这些间隙在轴突上快速传输电信号中起着关键作用。
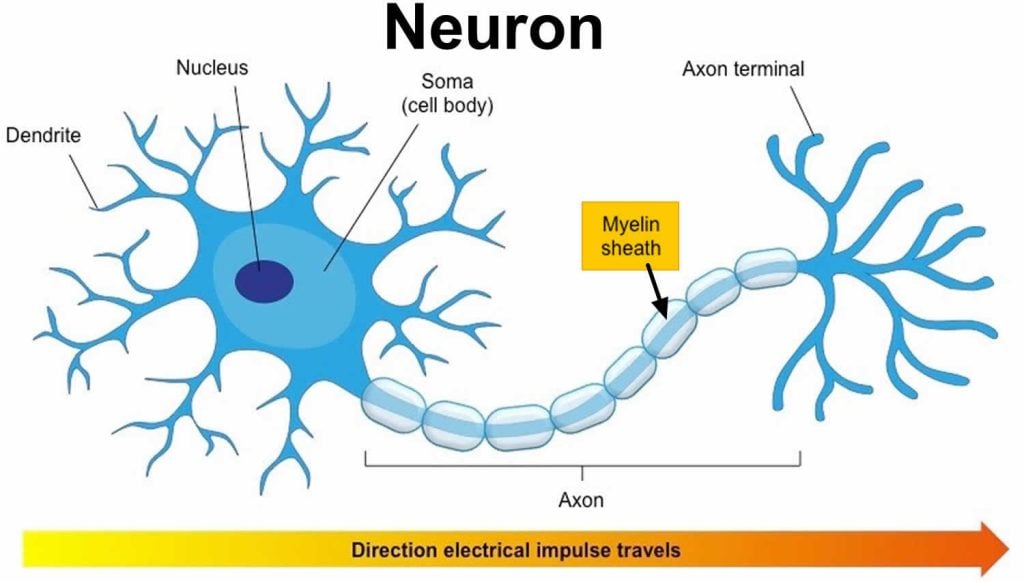
轴突通常被髓鞘完全包裹,以增加这些电信号的速度,使所有动作能够迅速进行。
髓鞘由脂质和蛋白质组成,形成一种白色脂肪物质,构成了包裹神经元轴突的保护套。髓鞘由多层紧密包裹在轴突周围的细胞膜组成。
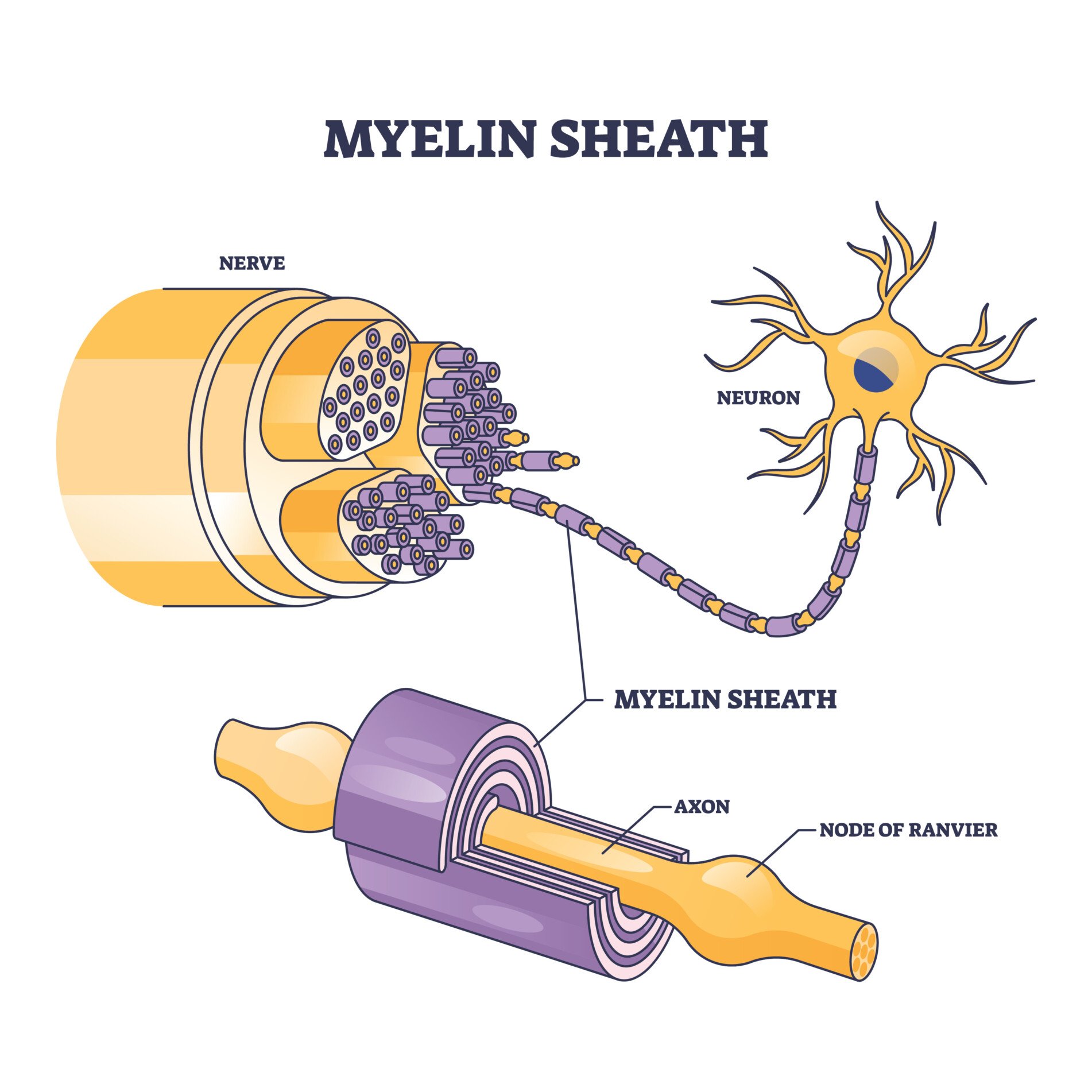
髓鞘之间有0.2到2毫米的间隔,这些间隔称为郎飞氏结。动作电位(神经冲动)沿着轴突从一个结跳到另一个结。这加快了信号的传递速度。
髓鞘是在19世纪中叶被发现的,当时科学家们通过显微镜观察神经元时注意到轴突周围有一层闪亮的白色物质。德国病理学家鲁道夫·魏尔肖观察到了这一点,并用希腊词“myelós”(意为核心)创造了“髓鞘”一词。
当时人们认为髓鞘位于轴突的核心。然而,后来发现它是包裹在神经元轴突上的物质。
髓鞘的功能
髓鞘的主要功能是为它所包围的神经元轴突提供绝缘。这种绝缘保护这些轴突的方式类似于电线的绝缘。
髓鞘是一种低电导率、高电阻的材料,这意味着它可以作为绝缘体而不干扰沿轴突传递的电信号。
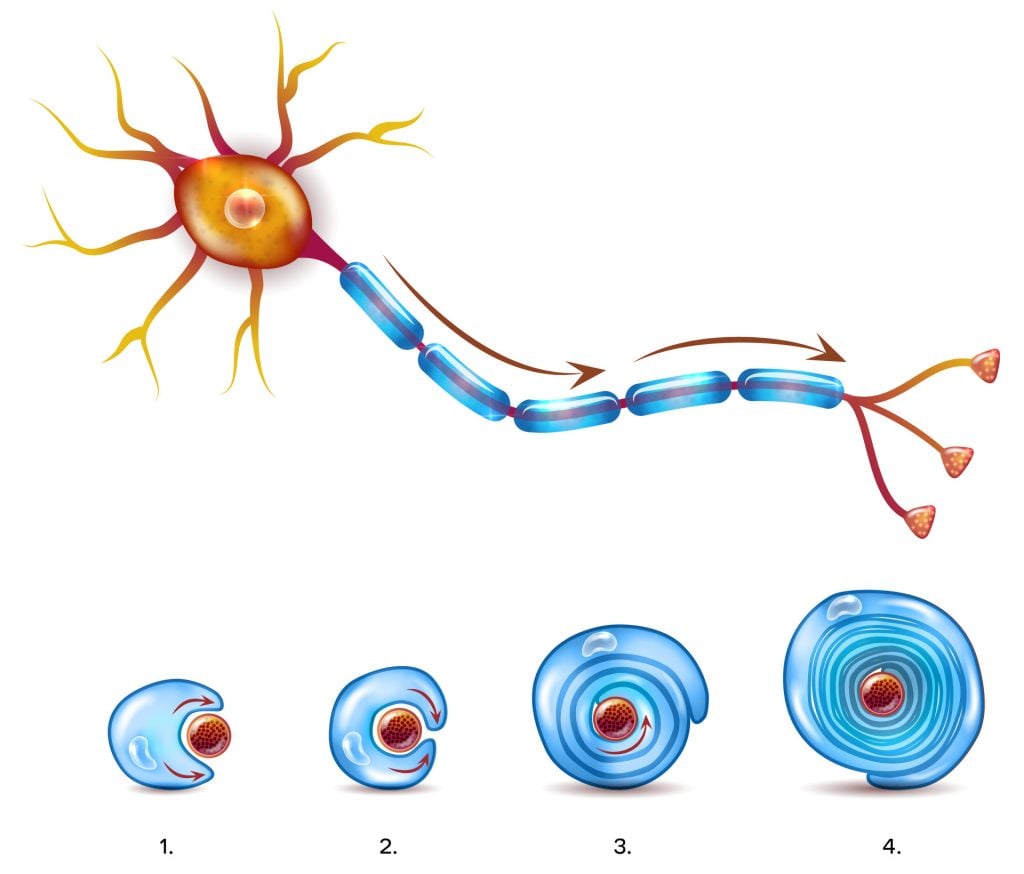
由于髓鞘为轴突提供了绝缘,这些轴突可以比没有髓鞘绝缘的轴突以更高的速度传导电信号。因此,轴突髓鞘化越彻底,电信号的传导速度就越快。
例如,最髓鞘化的轴突可以以每秒约70到120米的速度传导冲动,相当于赛车的速度。
同样,髓鞘围绕轴突可以防止电信号通过髓鞘并离开轴突。
它阻止离子进入或离开神经元,也称为去极化。这意味着动作电位的电流只会沿着轴突流动。
更多的动作电位意味着神经元可以更好地相互沟通,传递电信号和化学信息,保持大脑健康和正常运作。
虽然髓鞘包裹着轴突,但在髓鞘之间有一些小的未覆盖的间隙,称为郎飞氏结。这些是由髓鞘形成的特殊分子结构,包含电压敏感的钠离子和钾离子通道簇。
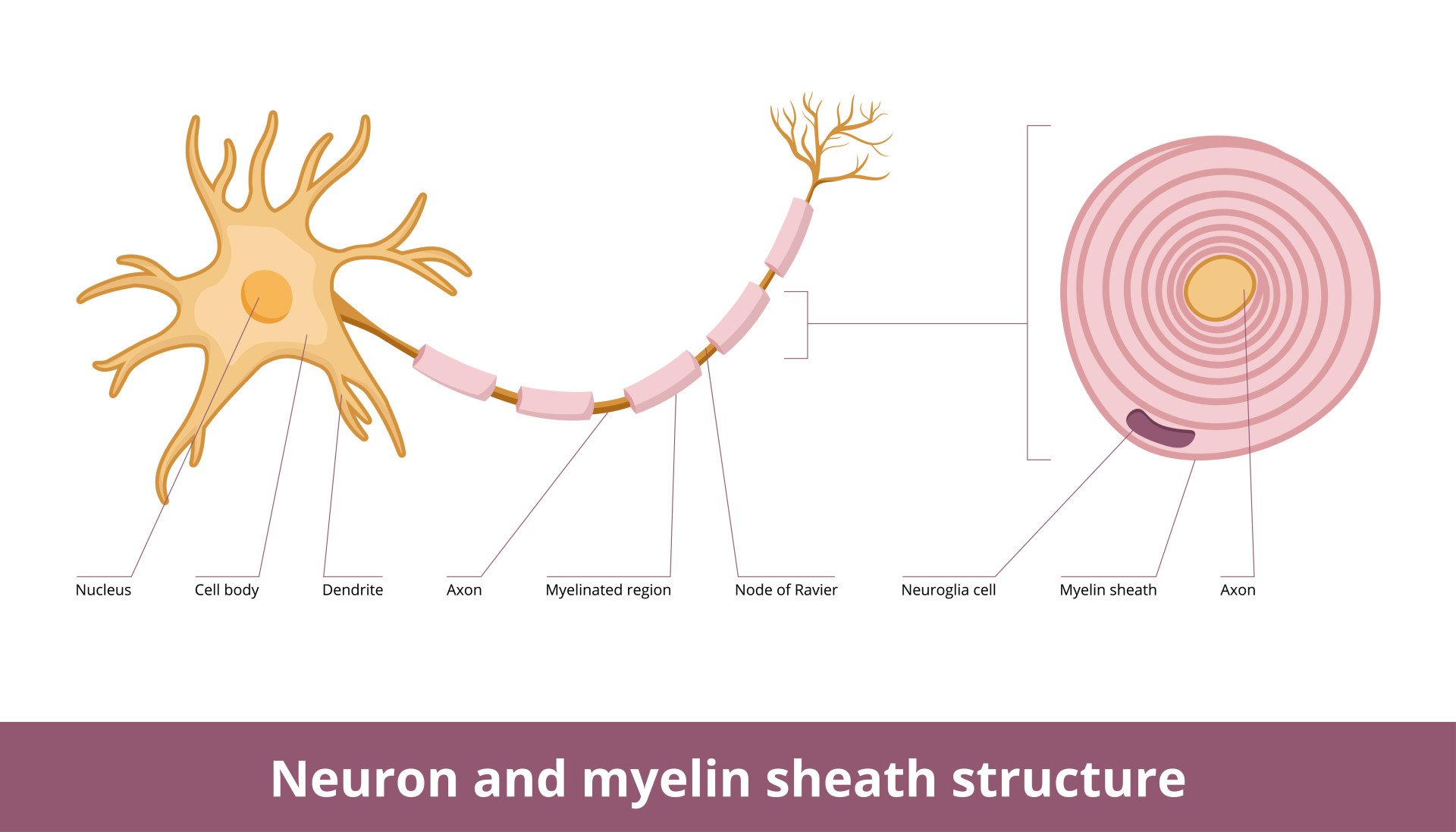
由于电信号无法通过髓鞘传递,它们会从一个郎飞氏结“跳跃”到另一个,在跳跃式传导中形成电信号。
这种传导类型对于电信号的快速形成非常重要,意味着需要较少的能量来传导电信号。这是因为髓鞘化的轴突需要较少的能量来传导冲动。
髓鞘在神经信号传导中的作用
髓鞘在确保我们的神经信号高效传递方面发挥着关键作用,它通过管理在信号传递过程中升高的钾水平来实现这一目标。
- 速度与效率:髓鞘有助于“跳跃式神经传导”,这是一种允许神经信号比无髓鞘纤维更快、更高效地传递的过程。
- 密封连接:为了实现快速传导,髓鞘必须紧密附着在轴突上。否则,存在信号泄漏的风险。
- 旁节点连接的重要性:缺乏某些旁节点成分的小鼠会出现严重的健康问题,证明了其重要性。这些连接还有助于保持重要的钠离子和钾离子通道分离,确保高效的信号传递。
- 钾调节:神经信号后,钾水平升高。髓鞘帮助管理和减少这些升高的钾水平,这对于持续高效的神经信号传递至关重要。
- 钾清除机制:髓鞘内部有通道和机制将钾转移出去,确保钾不会积累并干扰神经功能。星形胶质细胞(一种脑细胞)吸收多余的钾,然后将其释放到血液或脑脊液中。
- 驱动力:电压和渗透梯度的差异驱动水和钾的转移。神经信号后,轴突周围的空隙变得高度带电,有助于将钾推入星形胶质细胞,从而帮助清除钾。
新研究
1854年,鲁道夫·魏尔肖引入了“髓鞘”一词,源自希腊语中的“骨髓”,用于描述大脑中大量存在的结构。
自1949年以来,主流观点认为髓鞘的唯一功能是优化神经传导速度并最小化轴突中的能量使用。
然而,最近的研究挑战了这一观点,表明髓鞘及其形成细胞可以根据神经活动发生变化,从而影响神经回路的功能。
此外,越来越多的证据表明这些细胞通过髓鞘为神经元提供代谢支持。
对髓鞘及其与神经元关系的扩展理解不仅揭示了其在正常生理功能中的作用,还揭示了其在各种神经和精神疾病病理中的作用。
髓鞘化
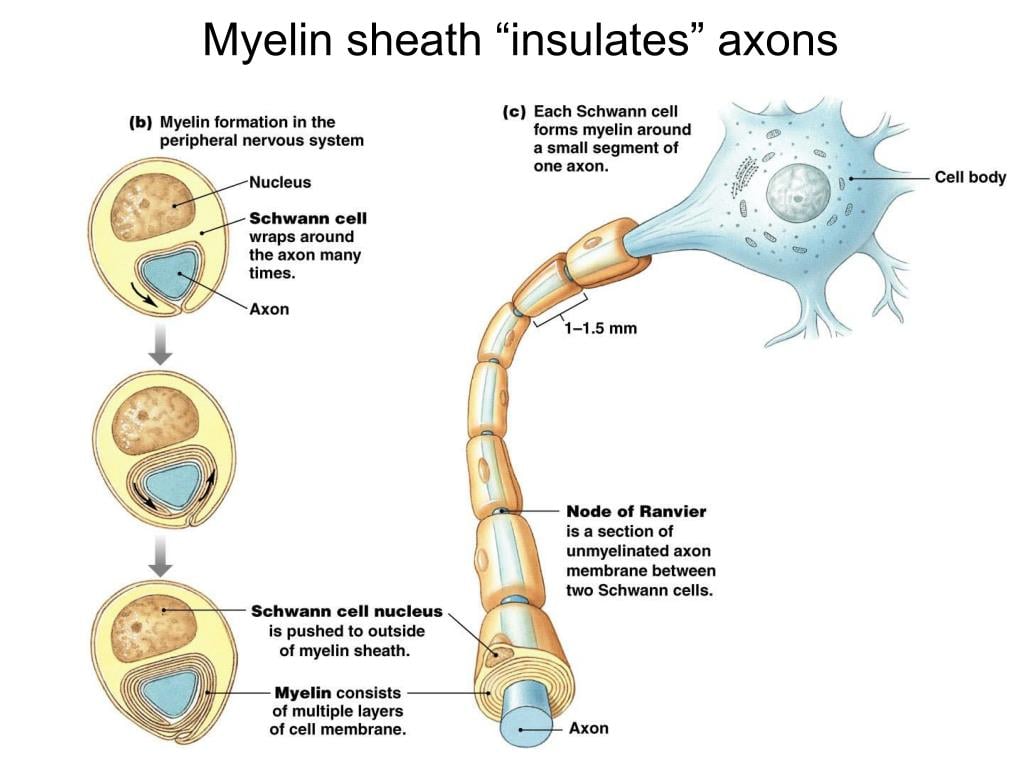
髓鞘化是指髓鞘的形成。因此,被这种绝缘保护套覆盖的轴突被称为髓鞘化的轴突。如果轴突周围没有髓鞘,则称为未髓鞘化的轴突。
一个人拥有的髓鞘化轴突越多,他们对刺激的反应速度就越快,因为髓鞘增加了神经冲动的传导速度。因此,未髓鞘化的轴突意味着个人反应不会很快。
同样,在未髓鞘化的轴突中,电信号不会因郎飞氏结而加速,这意味着信号会通过细胞的每一部分,减慢信号传导的速度。
髓鞘是由不同类型的胶质细胞产生的。胶质细胞位于CNS和PNS中,负责维持稳态,并为神经元提供支持和保护。
产生髓鞘的两种胶质细胞是施万细胞和少突胶质细胞。施万细胞位于周围神经系统(PNS),而少突胶质细胞位于中枢神经系统(CNS)。
施万细胞
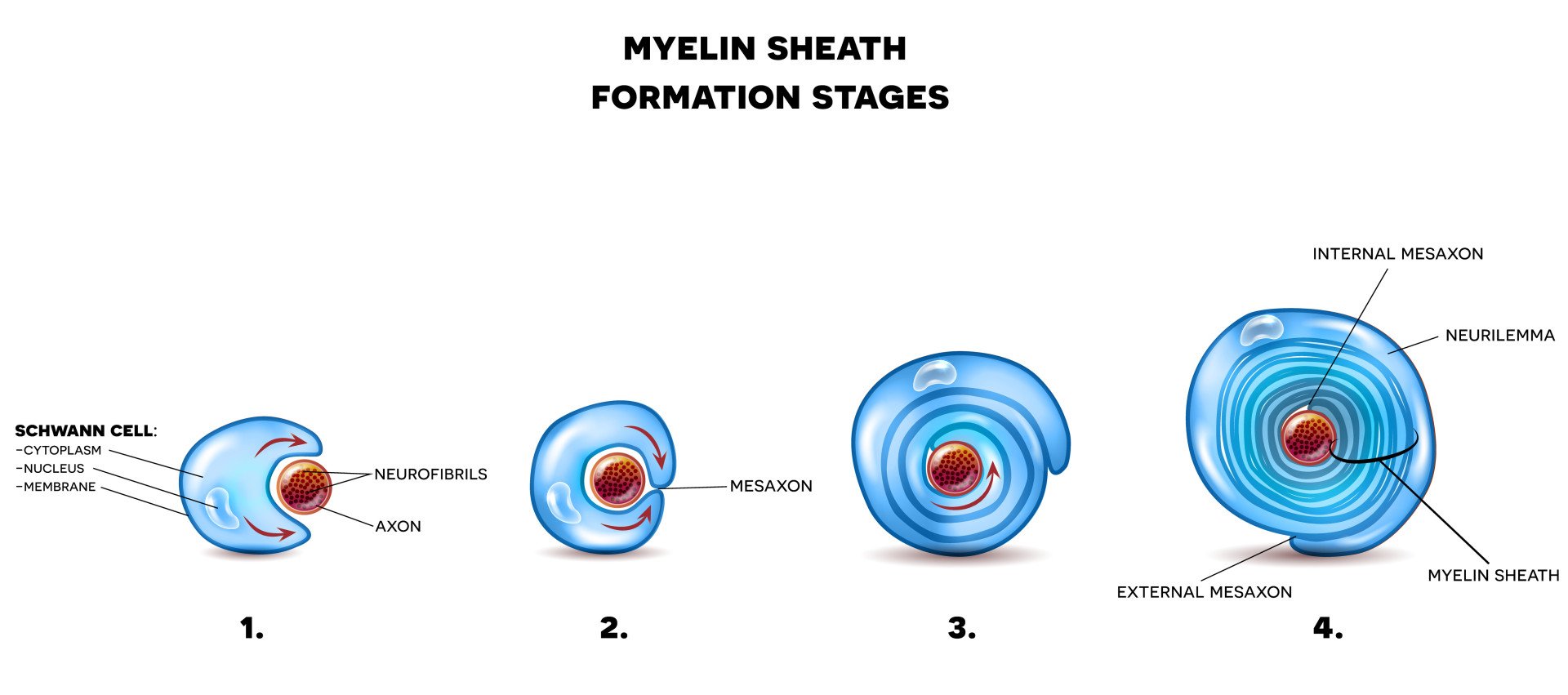
施万细胞起源于神经嵴,这是一组胚胎细胞。因此,施万细胞首先在胎儿发育期间开始髓鞘化轴突。施万细胞被一层称为基底膜的组织层包围。
基底膜的外侧覆盖着一层称为内膜的结缔组织层。内膜包含血管、巨噬细胞和成纤维细胞。最后,基底膜层的内表面面向施万细胞的质膜。
为了在周围神经系统中由施万细胞形成髓鞘,这些细胞的质膜需要围绕神经元的轴突同心地包裹,螺旋式地添加膜层。
这种质膜含有高浓度的脂肪,这对于髓鞘的构建至关重要。有时,多达100圈的施万细胞螺旋围绕神经元的轴突。
少突胶质细胞
最初,人们认为髓鞘是由神经元分泌的一种绝缘物质。然而,一个世纪后,Pio Del Rio Hortega 和 Wilder Penfield 的染色实验表明,髓鞘并非来自神经元,而是来自少突胶质细胞。
少突胶质细胞可以在多个轴突上生成多个髓鞘,从而促进快速的神经信号传导,尤其是在郎飞氏结处。
在中枢神经系统中,少突胶质细胞是胶质细胞,它们也创建髓鞘。少突胶质细胞是星形细胞,从其细胞体伸出约15条臂,这意味着它可以同时髓鞘化多个轴突。

与施万细胞一样,少突胶质细胞也会围绕神经元的轴突螺旋缠绕以形成髓鞘。然而,少突胶质细胞的细胞体和细胞核保持分离,不会像施万细胞那样围绕轴突缠绕。
少突胶质细胞反复螺旋围绕轴突形成富含脂质的膜,因此其功能类似于施万细胞。 一个少突胶质细胞可以同时协调地髓鞘化多个轴突。
髓鞘化的开始通常由中枢神经系统中的神经活动触发。这一点在对大鼠的研究中得到了证实,其中一些大鼠在黑暗中生长,而另一些则在光线下生长。
研究发现,在黑暗中长大的大鼠的视神经髓鞘化轴突较少,而那些不在黑暗中长大的大鼠则没有这种情况。
总体而言,研究表明髓鞘化的程度取决于神经活动的数量,增加的神经活动会增加髓鞘化的数量。
髓鞘化是否终生发生?
髓鞘化发生在胚胎发育过程中,然后从出生开始是一个连续的过程,大约在2岁时成熟。一旦达到这个阶段,运动和感觉系统就会成熟,大脑髓鞘化也基本完成。
然而,有些过程在生命后期才髓鞘化,例如丘脑和前额叶皮层之间的连接在5到7岁之间成熟。
同样,大脑皮层关联区域之间的髓鞘化会持续到20多岁和30多岁。通常,脑干和小脑内的髓鞘化会首先成熟,随后是大脑皮层各叶的髓鞘化成熟。
大多数20到29岁的人在相关区域髓鞘化成熟时,其身体表现能力将达到峰值。
然而,髓鞘化在整个成年期继续发展,特别是在负责整合信息以进行有意活动的关联区域,最终在50岁左右达到峰值。
尽管关联区域的髓鞘化仍在继续,但神经系统从20岁开始整体下降,皮层变薄,少突胶质细胞数量减少。
损伤
髓鞘化问题可能由损伤、感染、创伤、基因突变和自身免疫疾病引起。如果轴突上的髓鞘受损或无法形成,这可能导致电信号沿轴突传播速度减慢或中断。
髓鞘对于神经系统中神经元的正常运作至关重要:其提供的绝缘丧失可能会对正常功能造成损害。
最终,这可能会损害髓鞘化过程以及施万细胞和少突胶质细胞的功能,导致神经退行性病变。
根据问题的程度和所经历的状况,髓鞘化问题的个体可能出现以下一种或多种症状:
- 麻木
- 头晕
- 不协调或笨拙的动作
- 反射丧失
- 肌肉无力
- 肌肉痉挛
- 视力模糊或视力丧失
- 感觉变化或感觉丧失
- 疼痛
- 肌肉僵硬
髓鞘被破坏或不能正常工作的过程称为脱髓鞘。与脱髓鞘相关的疾病可以从急性到慢性不等。
吉兰-巴雷综合征是一种罕见的自身免疫性疾病,会损害周围神经系统的健康神经元。
这可能导致虚弱和麻木,最终可能导致瘫痪,使其成为一种危及生命的状况。由于该病导致神经元的轴突受损,它可能导致电信号传导受阻。
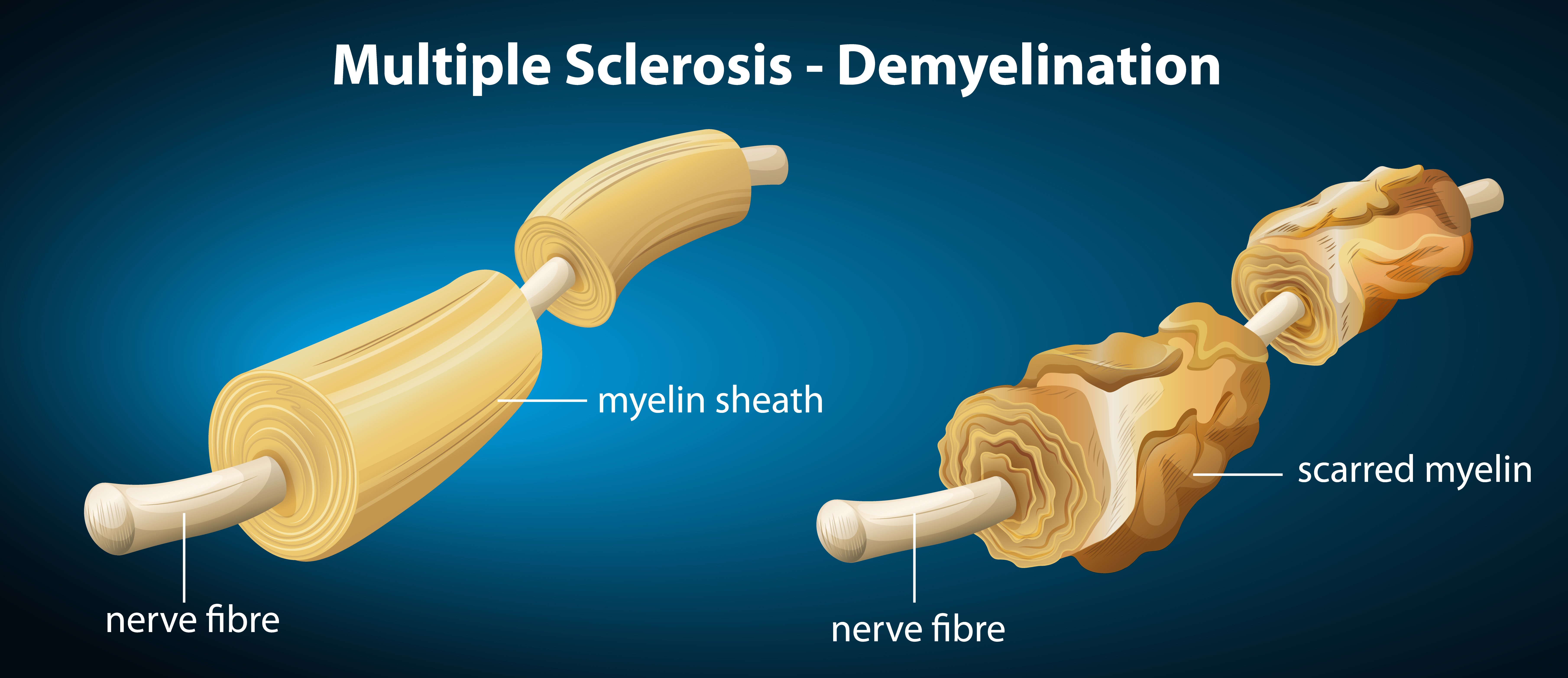
多发性硬化症(MS)是另一种影响髓鞘的脱髓鞘疾病。这种疾病导致个体的免疫系统攻击中枢神经系统,这意味着髓鞘将受损。
MS 可能会导致肌肉无力、协调能力受损,在最严重的情况下可能导致瘫痪。在 MS 中,身体的免疫系统会将髓鞘视为威胁,并攻击髓鞘及其制造细胞。
因此,这使得电信号难以通过神经元传导,导致神经元之间的通信受损。
最后,周围神经肿瘤如施万细胞瘤会影响产生髓鞘的施万细胞。施万细胞瘤通常是良性肿瘤,但在少数情况下可能是有害且癌变的。
虽然这些肿瘤很少有害,但它们可能导致神经损伤和运动控制丧失。这些肿瘤影响周围神经系统中产生髓鞘的细胞;这可能负面影响轴突传导电信号的方式,导致肌肉无力、麻木和疼痛等症状。
参考文献
Cech, D. J., & Martin, S. T. (2011). 功能性运动发展生命周期-E-Book . Elsevier Health Sciences.
Fields, R. D. (2008). 学习、认知和精神障碍中的白质. 神经科学趋势, 31(7), 361-370.
Fünfschilling, Ursula, Lotti M. Supplie, Don Mahad, Susann Boretius, Aiman S. Saab, Julia Edgar, Bastian G. Brinkmann 等. “糖酵解少突胶质细胞维持髓鞘和长期轴突完整性。” 自然 485, no. 7399 (2012): 517-521.
Huxley, A. F., & Stämpfli, R. (1949). 周围有髓鞘神经纤维跳跃传导的证据. 生理学杂志, 108(3), 315.
Moore, S., Meschkat, M., Ruhwedel, T., Trevisiol, A., Tzvetanova, I. D., Battefeld, A., Kusch, K., Kole, M. H. P., Strenzke, N., Möbius, W., de Hoz, L. & Nave, K. A. (2020). 少突胶质细胞在信息处理中的作用. 自然通讯, 11 (1), 1-15.
Kirkwood, C. (2015, 3月24日). 髓鞘:概述 . Brain Facts. https://www.brainfacts.org/brain-anatomy-and-function/anatomy/2015/myelin
Ratini, M. (2019, 8月7日). 什么是髓鞘? WebMD. https://www.webmd.com/multiple-sclerosis/myelin-sheath-facts
Osika, A. (2020, 10月29日). 髓鞘和髓鞘化 . Kenhub. https://www.kenhub.com/en/library/anatomy/the-myelin-sheath-and-myelination
Stadelmann, C., Timmler, S., Barrantes-Freer, A., & Simons, M. (2019). 中枢神经系统中的髓鞘:结构、功能和病理. 生理学评论, 99(3), 1381-1431.
引用来源
本文翻译自以下网站:
simplypsychology.org
使用声明
本文仅供教育和参考用途。如需转载或引用,请注明出处和作者。
如果你有任何问题或建议,请随时联系微信公众号。
